ノーベル生理学・医学賞を受賞した炎症反応を抑えるmRNAとは?
今回は、2023年10月2日に発表があったノーベル生理学・医学賞の受賞内容について勉強していきます。筆者は現在、システム生命科学について研究している博士課程大学院生です。ノーベル賞受賞の具体的な内容を知らなかったので、論文や記事・ChatGPTを基に調べてみました。
参考にした資料
今回は、以下3つの情報を元に勉強していきます。
ノーベル財団による今回の受賞発表のプレスリリース
受賞のきっかけとなった論文
Karikó, Katalin, et al. “Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA.” *Immunity* 23.2 (2005): 165-175.
https://www.sciencedirect.com/science/article/pii/S1074761305002116
NHKから出ているニュース記事
受賞理由は、新型コロナウイルスのmRNAワクチンの開発での大きな貢献
今年のノーベル生理学・医学賞は、アメリカ ペンシルベニア大学のカタリン・カリコ氏と、同ペンシルベニア大学のドリュー・ワイスマン氏という、2名の研究者が受賞しました。受賞理由は、「mRNAワクチンの開発を可能にした、ヌクレオシド塩基修飾に関する発見」でした。受賞に至った両者の研究は、『2020年初頭に始まった、COVID-19に対する効果的なmRNAワクチンの開発に不可欠であった』と評価されています。
mRNAワクチンの仕組み
ワクチンは、体内にウイルスや細菌の一部を入れることで、免疫システム(体を守る仕組み)を訓練します。これによって、本物のウイルスに感染したときにすぐに反応できるようになります。
開発されたmRNAワクチンは、人工的に合成した遺伝物質のメッセンジャーRNA(mRNA)を体内投与することで免疫応答を訓練します。私たちの細胞内では、DNAにコードされたmRNAに伝達され、これがたんぱく質を作るための設計図にあたる情報となります。設計図情報を基にウイルスの一部分と同じタンパク質を作られるため、免疫応答の訓練が可能になるというのがmRNAワクチンの仕組みです。
mRNAの臨床使用に立ちはだかった大きな壁
mRNAワクチンは、2023年現在でこそ当たり前のように臨床に使われ、普及しています。mRNAワクチンが臨床に使われることが、いつ承認されたかを振り返ると、モデルナやファイザーのワクチンが2020年12月という、超爆速での承認でした。実は、そのワクチン開発が成功するまでの歴史的背景を調べると、mRNAを扱う上でのいくつもの技術的課題がありました。
mRNA合成技術(in vitro転写:細胞培養なしでmRNAを生産する方法)は、1980年代には実現していましたが、合成したmRNAを医薬品として活用する上では、例えば以下のような課題がありました。そのため、『臨床目的のmRNA技術開発に対する熱意は、当初は限られたものであった』とのことです。
1.安定性の課題
mRNAは、遺伝情報の前駆体(ある化学物質についてその物質が生成する前の段階の物質)であるDNAに比べて、非常に不安定であるという性質があります。そのため、たんぱく質合成の前に体内中で容易に分解されてしまうという問題がありました。
【解決】この課題は、裸のmRNAをナノカプセル化する技術などによって解決されています。現在は、安定的なmRNAの細胞輸送システムが開発されています。
2.免疫応答の調節
mRNAは、狙ったたんぱく質が作られるようにし、体内で機能するようにすれば、医薬品として使うことができると期待されていました。しかし、mRNAは、ヒトに投与すると体内で強い炎症が引き起こされるため、医薬品に使うのは難しいのが課題でした。
【解決】この課題の解決に大きく貢献したことが、今回のノーベル賞を受賞するに至った功績です!!mRNAの修飾や設計の改良により、不要な免疫反応を抑制する方法が見つかりました。
受賞のきっかけとなった発見:mRNAのデザインにより炎症を抑制できる
前述の2つ目の課題である、mRNAの投与が炎症反応を引き起こしてしまう現象に対して、その炎症反応を抑える方法を提示したのが、カリコ氏らの2005年の論文です。カリコ氏らが提示したのは、mRNAに設計デザインの改良を加えると炎症反応を減らせるということです。
設計デザインとは具体的には、塩基修飾のことです。RNAにはA、U、G、Cの4つの塩基があります。これらに塩基修飾(分子構造に化学的に変更すること)を加えると、炎症反応はほとんど消失したというのが今回のブレークスルーです。その後の研究で、炎症反応抑制だけでなく、タンパク質産生を増加させるという発見もあり、結果としてmRNAワクチンの開発に大きく貢献しました。
mRNAを構成する物質の1つ、「ウリジン」を「シュードウリジン」という似た物質に置き換える方法で、医薬品として使うための基礎の確立につながりました。
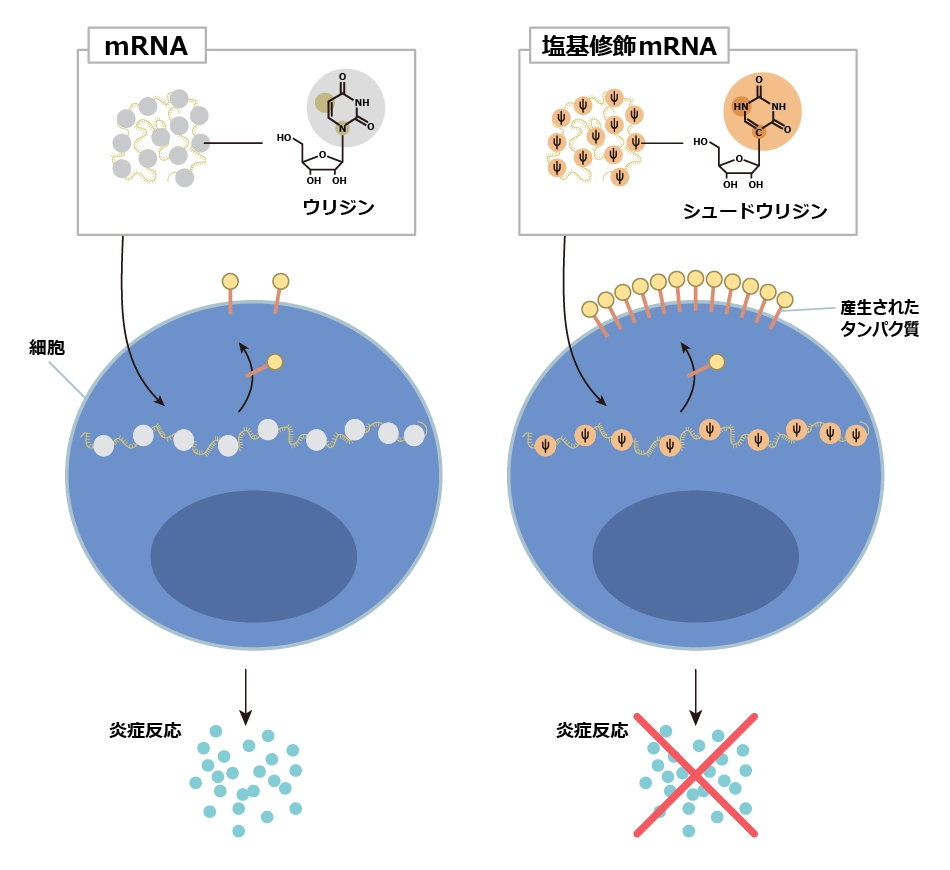
– ノーベル財団発表のリリースに基づいて、編集部で作成
mRNAには、A、U、G、Cと略される4つの異なる塩基が含まれています。ノーベル賞受賞者たちは、塩基を修飾したmRNAを細胞に送達することで、炎症反応の活性化(シグナル分子の分泌)を阻害し、タンパク質を作る量を増やせることを発見しました。
実際に2005年の研究論文の要約を読んでみましょう(抜粋、DeepLで翻訳)。
我々は、RNAがヒトTLR3、TLR7、TLR8を介してシグナルを伝達するが、修飾ヌクレオシドm5C、m6A、m5U、s2U、またはプソイドウリジンを組み込むと活性が消失することを示す。このような修飾RNAに暴露された樹状細胞(DC)は、非修飾RNAで処理したものに比べ、サイトカインや活性化マーカーの発現が有意に少ない。DCとTLR発現細胞は、細菌RNAとミトコンドリアRNAによって強力に活性化されるが、修飾ヌクレオシドが豊富な哺乳類全RNAでは活性化されない。ヌクレオシド修飾は、DCを活性化するRNAの可能性を抑制すると結論付けた。
TLRというのが免疫系(体を守るシステム)を示し、活性化すると免疫反応が起こります。修飾ヌクレオシドというのが、塩基修飾のことで、例えばm5C(5-メチルシトシン)はメチル基(-CH3)という化学構造を付与することに相当しています。なるほど、RNAに塩基修飾を施すことで、免疫系を起動させる力が弱くなったというのが、この論文の概要でした。
ワクチンは地道な研究の積み重ねで作られた
これまで見てきたように、ワクチン開発に至るまでにはいくつかの技術的困難がありました。それらが歴史的に克服されてきたおかげで、今日のワクチン基盤が整いました。2005年の論文がブレークスルーですから、実に15年後の歳月を経て大きな成果を出したということになります。このノウハウは、他の感染症のワクチンの開発にも道を開き、今後、がんの治療などへの応用が期待されています。









