iPS細胞より速い!ダイレクトリプログラミングの衝撃と可能性

今回は、細胞生物学の世界に革命をもたらす画期的な技術、その名も「ダイレクトリプログラミング」を解説します。ダイレクトリプログラミングは、その革新的な特性から、医療や生命科学の分野の進歩を担うと期待されています。
そして、この技術の肝細胞におけるパイオニアかつ世界におけるトップを走る研究グループが、我が九州大学!著者は、九州大学の大学院生として、実際にダイレクトリプログラミングを含む生命科学研究に取り組んでいます。現在の最新の研究成果を交えて、その内容とインパクトについて、論文を読みながら解説していきます!
“細胞の運命を直接書き換える”—それがダイレクトリプログラミング
細胞の運命を直接書き換える技術、これがダイレクトリプログラミングの直観的説明です。まず、名前がかっこよすぎますよね。著者は最初聞いた時かっこよすぎてたまげてひっくり返りそうになりました。
「ダイレクト(直接的)」という言葉が示すように、この技術は細胞を別の種類の細胞に直接変換します。中間段階を経ることなく、まっすぐに目的地へ向かうイメージです。
一方、「リプログラミング」は、細胞の「プログラム」を書き換えるという意味合いを持ちます。私たちの体の細胞は、それぞれが特定の役割を持っています。ある意味、細胞には一種の「プログラム」が書き込まれているのです。ダイレクトリプログラミングは、このプログラムを直接書き換えることで、細胞の運命を変えるのです。
誤解を恐れず言うなら、血の細胞だったのが”直接”肝臓の細胞に変わるのです。嘘みたいな本当のことですが、血が肝臓になるんです!
東京→大阪行くなら直接つないだらええやん!
例えば、皮膚の細胞を肝臓の細胞に変えるとします。
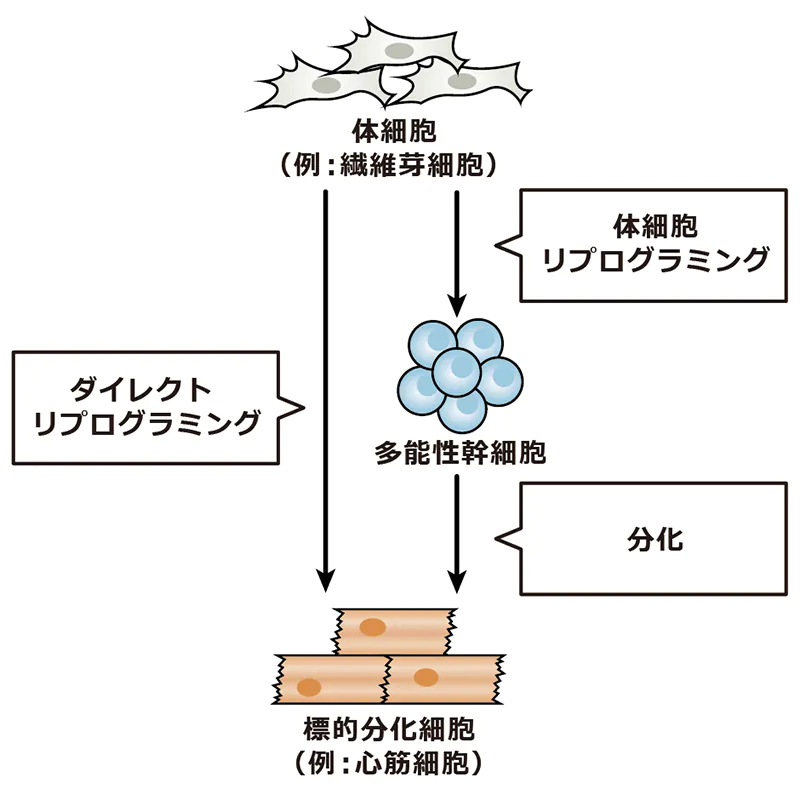
従来の方法では、まず皮膚細胞をiPS細胞(人工多能性幹細胞)に戻し、そこから改めて肝細胞へと分化させる必要がありました。iPS細胞は、京都大学の山中伸弥教授の研究で広く知られるようになりました。これは、いわば東京から大阪へ行くのに、わざわざ一度北海道を経由するようなものです。しかし、ダイレクトリプログラミングは、その名の通り「直接的」です。皮膚細胞から肝細胞へ、まっすぐに変換します。東京から大阪へ、最短ルートで向かうようなイメージです。この「直接性」こそが、ダイレクトリプログラミングの革新的な点なのです。
ダイレクトリプログラミングのプロセス
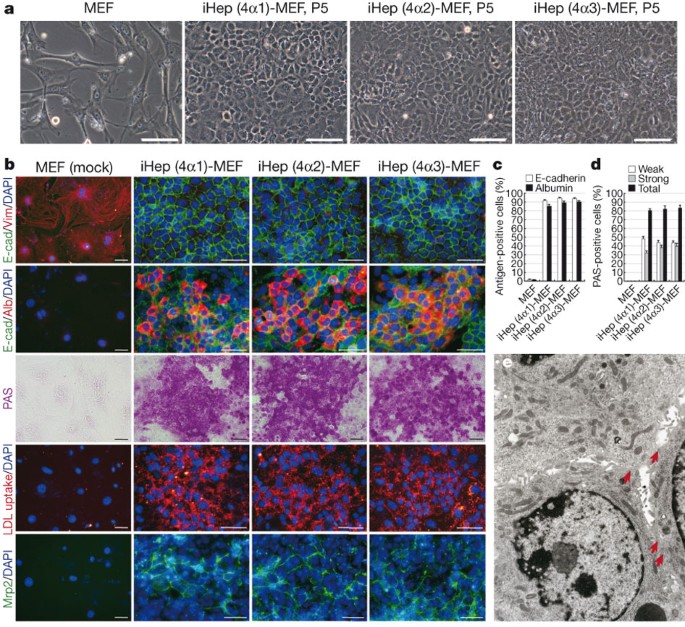
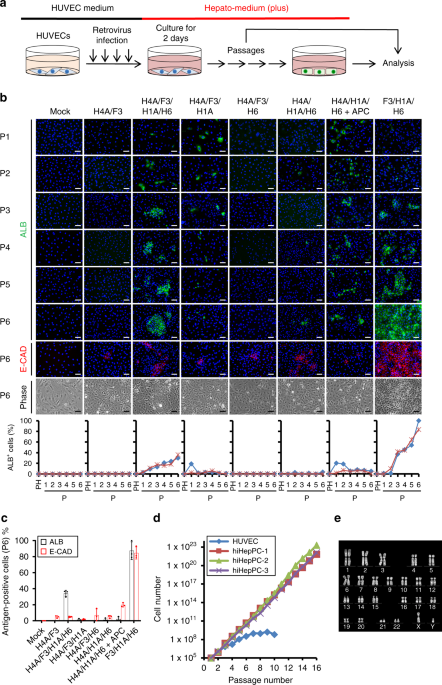
九州大学の鈴木教授らは、2011年にマウス検体を使って肝細胞つまり肝臓を構成する細胞を、ダイレクトリプログラミングすることに成功しました(Sekiya and Suzuki, Nature, 2011)。
そのプロセス自体は至ってシンプルで、皮膚から抽出した線維芽細胞(せんいがさいぼう:体のさまざまな組織に存在する基本的な細胞)に2つの「あるモノ」を導入することで、線維芽細胞から肝細胞の性質を有する「誘導肝細胞(iHepC)」へと変化させられるというのです。
(図は、 Wang, H., Yang, Y., Liu, J. et al. Direct cell reprogramming: approaches, mechanisms and progress. Nat Rev Mol Cell Biol 22, 410–424 (2021). https://doi.org/10.1038/s41580-021-00335-z を参考に編集部が作成)
「あるモノ」とは転写因子と呼ばれます。
転写因子とは、DNAに結合して遺伝子の転写発現を調節するタンパク質で、研究グループはある特定の転写因子の組み合わせを選択・同定し、導入することでiHepCができたと言います。
iPS細胞との違い:ダイレクトリプログラミングの方が速く作れる
ダイレクトリプログラミングと似た概念に、iPS細胞があります。これらは、どちらも細胞の運命を変える革新的な手法ですが、先ほど書いた通り、「直接(ダイレクト)」であるかどうかに違いがあります。概念図の通り、iPS細胞の場合は体細胞から出発してiPS細胞という、いろいろな細胞へ分化できる初期化中間状態を経て、目的の細胞へ分化させます。
この違いは、作るまでのスピードです。中間を経由した方が時間が掛かるのは直観的にも理解できますし、実際そうです。前述の例えで言うなら、北海道を経由しない方がより速く大阪に行けるということです。
最新の研究成果
わずか2つの転写因子の導入によって起こるダイレクトリプログラミングですが、科学では「レシピが明らかになっても、なぜそうなるのか初めの頃は分かっていない」ということはよくあります。この技術も、なぜそうなるのかというメカニズムは明らかになっていませんでした。
しかし2020年、九州大学並びに京都大学や国立国際医療研究センターなどとのグループから、ある論文が発表されました。研究グループらは、どのように転写因子が細胞の運命を急速かつ急激に変化させるのか、誘導肝細胞であるiHepCの形成過程における具体的なメカニズムを発表しました。内容は専門的ですが、自分の勉強も兼ねて実際に論文の和訳表現に対してその解釈を付けます。
論文のアブストラクト、DeepLを用いて和訳
(Horisawa, Kenichi, et al. “The dynamics of transcriptional activation by hepatic reprogramming factors.” *Molecular Cell* 79.4 (2020): 660-676.より)
2つの転写因子(Hnf4αとFoxa1、Foxa2、またはFoxa3)の特定の組み合わせは、マウスの線維芽細胞の肝細胞様細胞への直接変換を誘導できる。しかし、肝リプログラミングの基盤となる分子メカニズムはほとんど分かっていない。ここで我々は、Foxaタンパク質ファミリーメンバーとHnf4αがクロマチンに順次的かつ協同的に結合し、肝臓特異的遺伝子発現を活性化することを明らかにした。すべてのFoxaタンパク質はパイオニア因子として閉じたクロマチン領域に結合し、その領域を開くが、Foxa3は標的遺伝子の転写開始部位の遠位領域から近位領域へ移動し、RNAポリメラーゼIIと結合し、標的遺伝子を共走するユニークな可能性を持っている。Foxa3のこのような特徴的な性質は、線維芽細胞において肝予命を誘導するのに必須である。転写因子とRNAポリメラーゼIIとの同様の機能的結合は、転写活性化が細胞分化を誘導する他の文脈でも起こるかもしれない。
転写因子の協力プレー
- Hnf4αとFoxaというダイレクトリプログラミングの素材となる転写因子は、チームワークを発揮していて、順番にかつ協力してDNAに結びつくことで、肝臓になるための機能を発揮しています。
Foxaと呼ばれる転写因子の特別な能力
- Foxaは「パイオニア因子」と呼ばれる特別な能力を持っています。
- 通常は閉じているDNAの領域を開いて、他の因子が働きやすくする「開拓者」のような役割をします。
Foxa3の驚くべき動き
- Foxa3は、3種類あるFoxa(Foxa1、Foxa2、Foxa3)の中で特に面白いかつ必須の動きをします。
- DNAの遠い場所から近い場所へ移動し、遺伝子の「スイッチを入れる」場所に到達します。
- さらに、RNAポリメラーゼII(遺伝子を読み取る重要な酵素)とくっついて、一緒に遺伝子の上を動きます。
Foxa3が、特に重要な役割を果たしていることが分かりました。これは、より効率的なリプログラミング法の開発に役立つ可能性が開かれ、現在も研究は進められています。
この研究で明らかになったメカニズムは、他の細胞分化過程にも適用できる可能性があり、幅広い分野での応用が期待されます。
ダイレクトリプログラミングの臨床応用可能性
ある細胞から目的の細胞へ運命を変換するダイレクトリプログラミングは、なぜ重要なのでしょう?それは、臨床可能性と意味がめちゃあるからです。
ヒトは肝臓や腸、心臓など、生きていく上でとても大事な臓器をいくつも持っています。ですが、病気によりこれらの機能が失われてしまうとしたら、やはり必要になるのは迅速かつ安全な補完機能の獲得です。普遍的にあるような、別の皮膚細胞などから簡単にこれらの臓器に代替するような細胞を用意できたら…というのが、ダイレクトリプログラミングのモチベーションです。
臨床応用可能性 1-急性疾患の治療
急性肝不全や心筋梗塞などの緊急性の高い疾患に対して、迅速な細胞治療が可能になるかもしれません。患者自身の血管内皮細胞から短期間で必要な細胞(肝細胞や心筋細胞など)を作り出し、移植することで、従来の治療法では救えなかった命を救える可能性があります。
臨床応用可能性 2-再生医療の革新
さまざまな臓器や組織の再生に応用できる可能性があります。例えば、脊髄損傷患者の血管内皮細胞から神経細胞を作り出し、損傷部位に移植することで、運動機能の回復を促進できるかもしれません。
すでに、マウスを含む実験的な臨床応用研究は行われていて、さらなる発展が楽しみですね。
細胞生物学のパラダイムシフト-ダイレクトリプログラミング
ダイレクトリプログラミングは、まさに細胞生物学のパラダイムシフトを引き起こす技術です。その発展と応用は、医療や環境、食糧など、人類が直面するさまざまな課題の解決に貢献する可能性を秘めています。今後の研究の進展と、それに伴う新たな発見や応用が大いに期待されるところです。
参考文献
▼Horisawa, Kenichi, et al. “The Dynamics of Transcriptional Activation by Hepatic Reprogramming Factors: Molecular Cell” Molecular Cell 79.4 (2020): 660-676.
https://www.cell.com/molecular-cell/fulltext/S1097-2765(20)30502-5